Sifat dari reaksi
katalis :
1. Katalisator tidak akan berubah pada akhir
reaksi.
2. Secara konsep energi aktivasi, katalisator
akan menurunkan energi aktivasi.
3. Katalisator dengan jumlah sedikit dapat
mempercepat reaksi dari zat pereaksi yang banyak jumlahnya
4. Reaksi yang terjadi bukan reaksi rantai,
biasanya kecepatan reaksi berbanding lurus dengan konsentrasi katalisator.
5. Katalisator tidak mengubah letak
keseimbangan (K) untuk reaksi bolak balik.
6. Katalisator negatif, katalisator yang
menghentikan reaksi, biasanya digunakan pada reaksi berantai.
Penggolongan
reaksi katalis dapat dibagi menjadi dua, yaitu :
1. Reaksi katalis homogen.
2. Reaksi katalis heterogen.
Secara industri
reaksi jenis hetergon lebih banyak digunakan daripada reaksi homogen, sebagai
contoh oksidasi O2 dengan katalis V2O5 atau Pt.
Secara umum dan
mudah dimengerti, mekanisme kerja katalis ialah katalisator dengan satu atau
lebih zar pereaksi membentuk zar kompleks antara yang tidak stabil. Zat
kompleks ini bereaksi dengan zar pereaksi yang lain, dan katalisator menjadi
bebas kembali.
Pada mekanisme
reaksi yang terjadi, zat pereaksi yang diadsorpsi menerima sejumlah energi dan
dalam keadaan yang lebih aktif. Keperluan tenaga bebas untuk mengaktivasi pada
proses adsorpsi kimia jauh lebih besar dibandingkan tenaga bebas pada adsorpsi
fisis.
Hal yang perlu
dalam proes reaksi katalis dengan adsorpsi kimia adalah jumlah zat yang
diadsorpsi biasanya tidak akan lebih daripada monomolekul layer karena gaya yang mengikat zat pereaksi pada pemukaan
katalisator turun dengan cepat jika jarak bertambah.
Reaksi katalis
dengan zat pereaksi gas dan katalisator zat padat, bisa dianggap berlangsung
menurut mekanisme sebagai berikut \:
1. Difusi gas pereaksi dari fase gas masuk ke interface yaitu batas antara gas
denngan permukaan zat padat (difusi luar). Jika katalisatior berbentuk porous,
maka akan terjadi difusi dari permukaan luar masuk ke dapam pori – pori
katalisator dengan cara difusi knudsen dan atau difusi molekuler.
2. Adsorpsi gas – gas pereaksi pada puncak
aktid permukaan luar katalisator,. Jika yang teradsorpsi gas beratom dua maka
pada waktu teradsorpsi terdisosiasi menjadi dua atom yang teradsorpsi.
3. Reaksi permukaan terjadi antara gas yang
teradsorpsi dengan gas pereaksi lain yang masih ada di interface atau yang sudah teradsorpsi pada permukaan katalis.
4. Desorpsi hasil reaksi dari permukaan
katalisator, difusi gas hasil reaksi dari permukaan pori – pori katalisator ke
permukaan luar katalisator dengan cara difusi knudsen dan atau difusi molekuler.
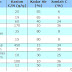
No.
|
Jenis
|
Adsorpsi Kimia
|
Adsorpsi Fisi
|
1.
|
Besarnya panas
adsorpsi
|
Biasanya lebih
besar daripada 20 Kcal/mol, dengan beberapa pengecualian --à 3ndotermis
|
Energi 2- 6 kcal/mol, jarang melebihi panas
pencairan
|
2
|
Reaksi Bolak
ballik
|
Mungkin bolak
ballik, mungkin juga tidak bolak balk
|
Lekas terjadi
proses sebaliknya
|
3
|
Tenaga aktivasi
|
Tinggi diatas
>20 kcal/mol
|
Rendah, 2
kcal/mol
|
4
|
Kecepatan
adsorpsi
|
Dapat cepat
atau lambat tergantung temperatur
|
Cepat, dibatasi
oleh kecepatan difusi
|
5
|
Interval
temperatur
|
Dapat terjadi
pada suhu tinggi, biasanya di atas titik didih
|
Terjadi pada
temperatur sekitar titik didih
|
6
|
Penggunaan
|
Keaktifan
permukaan katalisator dan reaksi kimia
|
Menentukan luas
permukaan katalisator dan distribbusi pori
|
7
|
Spesifik
|
Sangat spesifik
|
Umum
|
8
|
Lapisan gas
pada permukaan katalisator
|
Monolayer
|
multilayer
|














COMMENTS