Gas mulia adalah
unsur-unsur golongan VIIIA (18) dalam tabel periodik.
Disebut mulia karena unsur-unsur ini sangat stabil (sangat sukar bereaksi) dan sebagian
ditemukan di alam dalam bentuk monoatomik. Tidak ditemukan satupun senyawa
alami dari gas mulia. Menurut Lewis, kestabilan gas mulia tersebut
disebabkan konfigurasi elektronnya yang terisi penuh, yaitu konfigurasi oktet (duplet untuk Helium).
Kestabilan gas mulia dicerminkan oleh energi ionisasinya yang sangat besar, dan afinitas elektronnya yang
sangat rendah (bertanda positif). Para ahli
zaman dahulu yakin bahwa unsur-unsur gas mulia benar-benar inert. Pendapat ini dipatahkan, setelah
pada tahun 1962,Neil Bartlett, seorang ahli kimia dari Kanada berhasil membuat
senyawa xenon, yaitu XePtF6. Sejak itu, berbagai senyawa gas mulia
berhasil dibuat.
Gas mulia adalah gas yang
mempunyai sifat lengai, tidak reaktif, dan susah bereaksi dengan bahan kimia
lain. Gas mulia banyak digunakan dalam sektor perindustrian. Berikut adalah
gas-gas mulia:
Helium → Helios
(Yunani) : matahari = 0,00052 %
Neon → Neos (Yunani) : baru = 0,00182 %
Argon →Argos
(Yunani) : malas = 0,934 %
Kripton → Kriptos (Yunani) : tersembunyi = 0,00011 %
Xenon → Xenos (Yunani) : asing = 0,000008 %
Radon → Radium = Radioaktif
Neon → Neos (Yunani) : baru = 0,00182 %
Argon →
Kripton → Kriptos (Yunani) : tersembunyi = 0,00011 %
Xenon → Xenos (Yunani) : asing = 0,000008 %
Radon → Radium = Radioaktif
Tapi di alam
semesta kandungan Helium paling banyak diantara gas mulia yang lain karena
Helium meupakan bahan bakar dari matahari. Radon
= amat sedikit jumlahnya di atmosfer atau udara. Dan sekalipun ditemukan akan
cepat berubah menjadi unsur lain, karena radon bersifat radio aktif. Dan karena
jumlahnya yang sangat sedikit pula radon disebut juga sebagi gas
jarang.
Sifat Gas Mulia
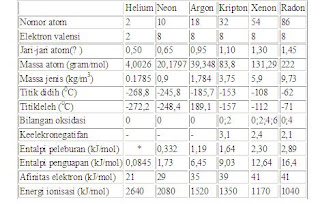
Gas mulia memiliki beberapa sifat baik secara fisis maupun kimia, sebelum membahas hal tersebut mari kita lihat data-data dari gas mulia.
Berikut merupakan beberapa ciri fisis dari gas mulia.
Sifat Fisis
Gas mulia
merupakan unsur gas pada suhu kamar dan mendidih hanya beberapa derajat di atas
titik cairnya. Jari-jari, titik leleh serta titik didih gasnya mulanya
bertambah seiring bertambahnya nomor atom. Sedangkan energi pengionnya
berkurang.
Dari data-data di atas kita bisa lihat bahwa nomor atom, jari-jari atom,
Elektron valensi gas mulia sudah memenuhi kaidah Duplet untuk He dan kaidah Oktet untuk Ne, Ar, Kr, Xe dan Rn. Sedangkan untuk He, Ne, Ar tidak memiliki nilai keelektronegatifan. Dan bilangan oksidasi yang di atas adalah bilangan oksidasi yang sudah di ketahui hingga sekarang.
Sifat Kimia
Kereaktifan gas mulia akan berbanding lurus dengan jari-jari atomnya, jadi kereaktifan gas mulia akan bertambah dari He ke Rn hal ini disebabkan pertambahan jari-jari atom menyebabkan daya tarik inti terhadap elektron kulit luar berkurang, sehingga semakin mudah ditarik oleh atom lain.
Tetapi gas mulia adalah unsur yang tidak reaktif karena memiliki konfigurasi elektron yang sudah satbil, hal ini didukung kenyataan bahwa gas mulia di alam selalu berada sebagai atom tunggal atau monoatomik. Tetapi bukan berarti gas mulia tidak dapat berreaksi, hingga sekarang gas mulia periode 3 ke atas (Ar, Kr, Xe, Rn) sudah dapat berreaksi dengan unsur yang sangat elektronegatif seperti Flourin dan Oksigen.
Reaksi pada Gas Mulia
Berikut adalah beberapa contoh Reaksi dan cara pereaksian pada gas mulia
Berikut adalah beberapa contoh Reaksi dan cara pereaksian pada gas mulia
Kegunaan Gas Mulia
·
Helium
Sebagai pengisi Balon udara, hal ini dikarenakan helium adalah gas yang
Helium merupakan zat yang ringan dan tidak muadah terbakar, Helium biasa digunakan untuk mengisi balon udara, dan helium yang tidak reaktif digunakan untuk mengganti nitrogen untuk membuat udara buatan yang dipakai dalam penyelaman dasar laut. Helium yang berwujud cair juga dapat digunakan sebagai zat pendingin karena memiliki titik uap yang sangat rendah.
Sebagai pengisi Balon udara, hal ini dikarenakan helium adalah gas yang
Helium merupakan zat yang ringan dan tidak muadah terbakar, Helium biasa digunakan untuk mengisi balon udara, dan helium yang tidak reaktif digunakan untuk mengganti nitrogen untuk membuat udara buatan yang dipakai dalam penyelaman dasar laut. Helium yang berwujud cair juga dapat digunakan sebagai zat pendingin karena memiliki titik uap yang sangat rendah.
·
Neon
Neon biasanya digunakan untuk mengisi lampu neon. Selain itu juga neon dapat digunakan untuk berbagi macam hal seperti indicator tegangan tinggi, zat pendingin, penangkal petir, dan mengisi tabung televise.
Neon biasanya digunakan untuk mengisi lampu neon. Selain itu juga neon dapat digunakan untuk berbagi macam hal seperti indicator tegangan tinggi, zat pendingin, penangkal petir, dan mengisi tabung televise.
·
Argon
Argon dapat digunakan dalam las titanium dan stainless steel. Argon juga digunakan dalam las dan sebagai pengisi bola lampu pijar.
Argon dapat digunakan dalam las titanium dan stainless steel. Argon juga digunakan dalam las dan sebagai pengisi bola lampu pijar.
·
Kripton
Kripton bersama argon digunakan sebagai pengisi lampu fluoresen bertekanan rendah. Krypton juga digunakan dalam lampu kilat untuk fotografi kecepatan tinggi.
Kripton bersama argon digunakan sebagai pengisi lampu fluoresen bertekanan rendah. Krypton juga digunakan dalam lampu kilat untuk fotografi kecepatan tinggi.
·
Xenon
Xenon dapat digunakan dalam pembuatan lampu untuk bakterisida (pembunuh bakteri) dan pembuatan tabung elektron.
Xenon dapat digunakan dalam pembuatan lampu untuk bakterisida (pembunuh bakteri) dan pembuatan tabung elektron.
·
Radon
Radon dapat digunakan dalam terapi kanker karena bersifat radioaktif. Radon juga dapat berperan sebagai sistem peringatan gempa, Karena bila lepengn bumi bergerak kadar radon akan berubah sehingga bias diketahui bila adanya gempa dari perubahan kadar radon.
Radon dapat digunakan dalam terapi kanker karena bersifat radioaktif. Radon juga dapat berperan sebagai sistem peringatan gempa, Karena bila lepengn bumi bergerak kadar radon akan berubah sehingga bias diketahui bila adanya gempa dari perubahan kadar radon.














COMMENTS